我们因新冠疫苗知晓了mRNA技术,然而你或许并不清楚,在此背后已然历经了四代技术路线的迭代,并且未来的mRNA药物会对肿瘤以及罕见病的治疗格局予以彻底改变。
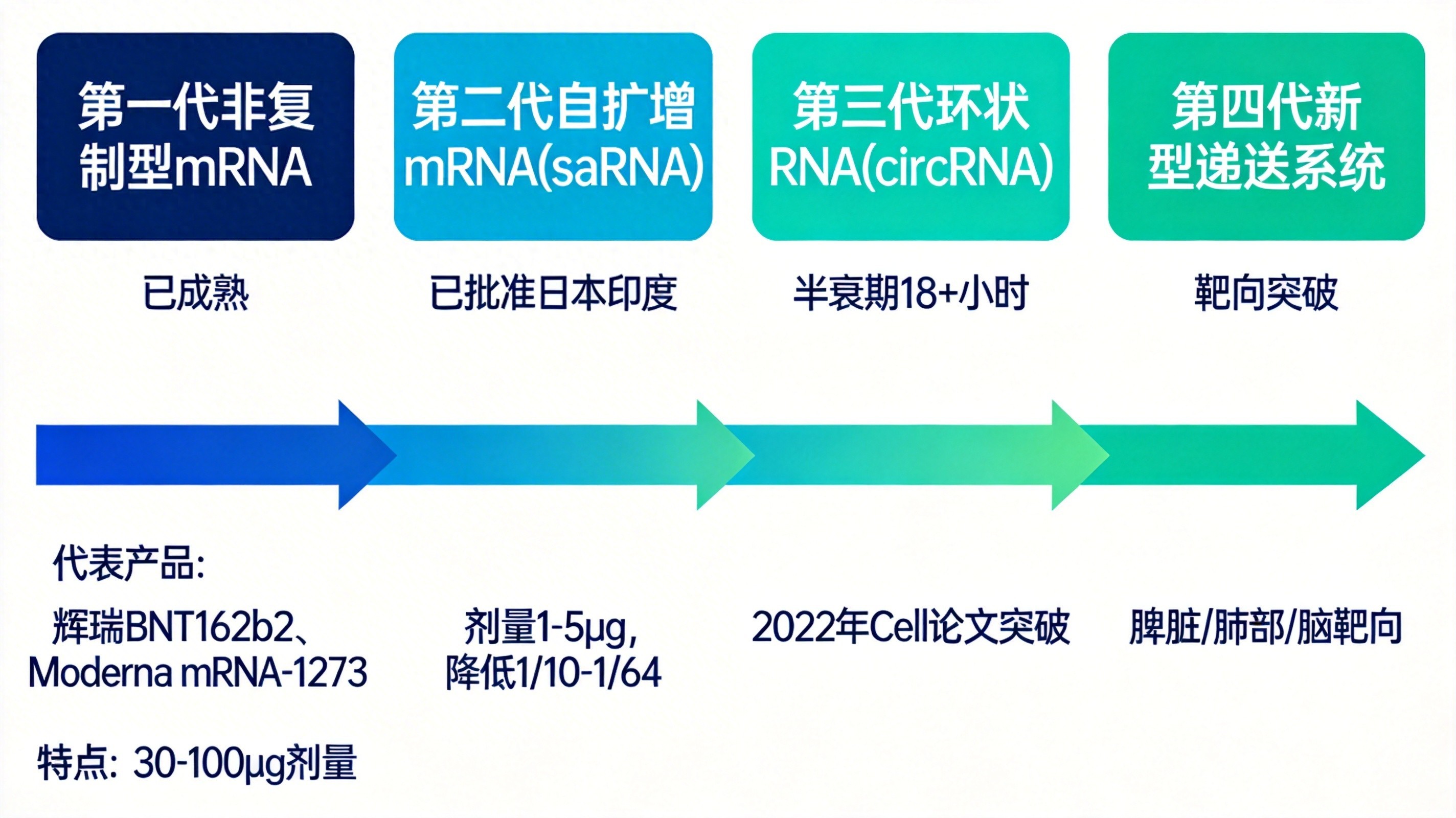
从新冠到癌症四代同堂的技术图谱
基石是目前全球上市的第一代传统非复制型mRNA,它采用假尿苷修饰来降低免疫原性,配合四组分的脂质纳米颗粒递送系统,通过两到三次接种,以30到100微克的高剂量完成,新冠疫苗和今年获批的呼吸道合胞病毒疫苗都属于这一代,流感疫苗也已进入三期临床。
针对第二代自扩增mRNA,人们将剂量大幅降低,降至仅需1到5微克。它携带有病毒复制酶基因,进而进入细胞之后能够自我复制,从而使抗原表达到一个更高的水平,并且能够持续更长的时间。然而,其分子量约为12kb,相对较高,如此一来,对递送载体的要求也就随之显著提高,技术面临的挑战明显加大了。
第三代环状RNA,正迅速地兴起。其共价闭合环状结构,没有末端,稳定性提高三至五倍,半衰期从四至七小时,延长至十八小时以上。北京大学魏文胜团队,2022年在《细胞》发文,证实新冠疫苗的广谱保护效果,清华大学林欣团队,2025年更达成了鼻内肺癌疫苗,使肿瘤缩小83%。
靶向性瓶颈正被第四代新型递送系统突破,脾脏靶向借助添加阴离子脂质的五组分LNP达成,肺部靶向通过用DOTAP修饰LNP进行鼻内给药来实现,两性离子脂质取代PEG规避了抗PEG抗体问题,外泌体载体因天然生物相容性成为全新方向。
六大关键问题决定未来十年成败
稳定性与储运难题
当前,仍有百分之八十的mRNA需要在零下七十度的环境下进行保存,其于血液里的半衰期连两分钟都不到。瑞科生物借助冻干技术达成了在四度以及二十五度的条件下稳定保存六个月的成果,耐热LNP运用咪唑修饰脂质在二十五度时也取得了相同的成效。进行序列优化同样有着重要意义,通过密码子优化能够把半衰期从五点三分钟延长至二十点一分钟。
递送系统的精准靶向性
这时,LNP约80%被肝脏库普弗细胞截获,脱靶效应很是明显。主动靶向策略于表面修饰CD8阳性T细胞靶向肽或维生素接枝脂质而起始,简化组分的三组分甚至双组分LNP能够提升特定器官的靶向效率。
安全性与免疫平衡
有一种物质叫游离刺突蛋白,曾在心脏以及大脑当中检测到有残留情况,而LNP诱导的那种补体激活相关伪过敏反应,同样也是值得人们提高警觉去留意的。青年男性群体里心肌炎发病率大概是五千分之一,这样的情况促使业界着手去开发生物可降解脂质,目的在于降低可电离脂质的毒性,与此同时还在全力探索着非炎症性佐剂系统。
生产工艺与成本控制
酶以及核苷酸原料纯度方面,体外转录有着极高要求,微流控混合设备价格昂贵,并且批次一致性难以确保。纤维素起到选择性吸附dsRNA的作用,正逐渐取代传统低效纯化方法,AI辅助序列优化能够极大减少试错成本,连续化生产工艺也在处于开发的进程里。
个性化医疗的技术门槛
模式是一患一苗,从测序开始到接种,要控制在两到四周内,然而目前这成本高达十万美元。抗原预测的准确性,仍旧需要AI算法再进一步优化,小批量定制化生产,也缺少标准化流程。针对KRAS和p53等常见突变的共享抗原疫苗,成为折中方案。
新型平台的安全验证
复制型的mRNA于复制进程当中会生成双链RNA,极易引发强烈的干扰素反应,核苷修饰跟复制酶的兼容性问题还没有被彻底解决,环化效率以及规模化生产工艺同样面临着挑战,体内代谢途径连同长期分布数据依旧需要去积累。
未来十年竞争关键要点已然明晰:究竟是谁能够在最先达成常温存储、以低成本进行生产以及实现针对器官的特异性递送这几方面,谁便能够稳稳占据下一代生物制药领域的领先地位。在从预防性疫苗朝着治疗性药物全面开展拓展的进程里,你觉得mRNA技术比较有可能在最先攻克某一种重大疾病?欢迎大家点赞并分享,在评论区域讲讲你的观点。